Tebentafusp en melanoma uveal
 Nº475
Nº475
Resumen
Tebentafusp es un nuevo fármaco antineoplásico consistente en una proteína de fusión biespecífica compuesta por un receptor de linfocitos T (RLT: dominio marcador) fusionado a un fragmento de anticuerpo anti-CD3 (dominio efector). El RLT se une con alta afinidad a un péptido derivado de gp100 presentado por el antígeno leucocitario humano A02:01 (HLA-A02:01) en la superficie de las células cancerosas del MU, mientras que el dominio efector se une a linfocitos T policlonales, dando lugar a una sinapsis inmunitaria que favorece la proliferación y redirige y activa a los linfocitos T policlonales productores de citocinas con actividad inflamatoria y citolítica, que atacan de forma directa a las células tumorales.
En base a este mecanismo, el medicamento, con designación huérfana, ha sido autorizado para el tratamiento en monoterapia del melanoma uveal irresecable o metastásico en pacientes adultos con HLA-A02:01 positivo. Su eficacia clínica fue contrastada en un estudio pivotal de fase 3, multicéntrico, abierto, aleatorizado y con control activo, en pacientes con MU metastásico con HLA-A02:01 positivo para el que no habían recibido tratamiento previo. Con un seguimiento de 14,1 meses, el tratamiento con tebentafusp se asoció con un incremento estadísticamente significativo de la supervivencia global (SG) –variable principal– hasta los 21,7 meses, frente a 16,0 meses en el brazo de control, lo que se tradujo en una reducción del 49 % en el riesgo de muerte. La supervivencia libre de progresión (variable secundaria) se redujo a algo más de 3 meses (solo ligeramente superior al control), si bien la diferencia frente al control en la tasa de respuesta objetiva (del 10,3 % en los pacientes tratados con tebentafusp vs. 4,8 %) no alcanzó significación estadística. Esos resultados se mantuvieron en periodos más prolongados: tras un seguimiento de 3 años se observó una reducción del 32 % del riesgo de muerte, con una mediana de SG superior para tebentafusp frente al grupo de control (21,6 vs. 16,9 meses). Además, en pacientes pretratados, los datos de un estudio de fase 2 apuntan a una SG de casi 17 meses (vs. < 12 meses en una cohorte histórica).
Desde el punto de vista de la seguridad, todos los pacientes incluidos en el estudio pivotal experimentaron al menos un evento adverso. En el brazo de tebentafusp, el 99 % se consideraron asociados al fármaco y, de estos, los más frecuentes fueron pirexia, prurito, erupción cutánea, fatiga, náuseas y escalofríos. Una elevada proporción de los casos de pirexia se relacionó con la aparición del síndrome de liberación de citocinas (SLC), el evento adverso grave más frecuente (10 %), si bien en la mayor parte de los casos (88 %) éste fue de grado 1 o 2; además, su frecuencia e intensidad parecen más comunes al inicio del tratamiento, tendentes a disminuir con el paso del tiempo.
Tebentafusp no es el primer medicamento consistente en una proteína de fusión, pero sí es el primero dirigido a bloquear a gp100. Su administración en pacientes con MU metastásico o irresecable se asocia con un incremento clínicamente relevante de la supervivencia en comparación con los fármacos habitualmente empleados en este contexto terapéutico –que carecen de indicación específica–, si bien la tasa de respuesta es baja (10 %).
Aunque el perfil de toxicidad de tebentafusp –en el que sobresale una moderada incidencia de SLC– no es desdeñable, parece clínicamente manejable con adecuado tratamiento y vigilancia, por lo que se puede considerar que sus beneficios superan claramente a sus riesgos. Tebentafusp es, por tanto, el primer tratamiento que ha conseguido mejorar el pronóstico de estos pacientes en décadas, posicionándose como la principal opción para pacientes con melanoma uveal HLA-A*02:01 positivo, tanto en primera como en sucesivas líneas.
Aspectos fisiopatológicos
El melanoma uveal (en adelante, MU) es el tumor maligno del ojo adulto más frecuente: representa en torno al 85 % de los casos de cáncer primario intraocular. Se trata de una entidad con alto grado de malignidad compuesta por un subconjunto de tipos de melanoma, que representa menos del 5 % de todos los casos de melanoma en los países desarrollados, pero constituye el caso de melanoma no cutáneo más incidente.
Desde el punto de vista de su biología, clínica y caracteres genéticos, el MU es completamente distinto del melanoma cutáneo, por lo que se abordarán aquí sus aspectos más relevantes sin referencia al más conocido melanoma de la piel.
Mientras que los melanomas cutáneos tienen una carga de mutaciones tumorales muy alta, con un papel crucial de las mutaciones de los genes BRAF y NRAS, el MU no presenta mutaciones en BRAF sino que predominan mutaciones en los genes codificantes para la proteína de unión a nucleótidos de guanina, el polipéptido q y alfa 11, si bien tiene una de las cargas mutacionales más bajas de todos los cánceres: esto da como resultado una escasez de neoantígenos que dificulta la eficacia de la inmunidad antitumoral natural y supone una menor sensibilidad a los fármacos biológicos inhibidores de los puntos de control inmunitario respecto al melanoma cutáneo. Otras diferencias entre ambas entidades clínicas radican en el modo de propagación (la diseminación hematógena es más común en el MU por la ausencia de vasos linfáticos en la úvea, mientras que la linfática predomina en los melanomas de piel) y en la presencia de un microambiente tumoral altamente inmunosupresor en el MU.
En el MU se han descrito una serie de alteraciones genéticas propias, de las cuales la más frecuente es la monosomía del cromosoma 3, seguida de alteraciones estructurales de los cromosomas 1, 6 y 8. La pérdida de un cromosoma 3, presente en aproximadamente la mitad de los casos, es un factor de mal pronóstico por sí misma, ya que se asocia a una menor supervivencia y mayor riesgo de metástasis, incluidas las localizaciones extraoculares; suele coexistir con la pérdida de expresión de la proteína 1 asociada a BRCA (BAP1), también factor de riesgo para el desarrollo de metástasis en pacientes con MU. A nivel fenotípico, destaca un ambiente inflamatorio caracterizado por una alta expresión de los antígenos leucocitarios humanos HLA, un evento importante para los enfoques de inmunoterapia.
En sentido estricto, el melanoma uveal surge de los melanocitos de la úvea de un ojo (el MU bilateral es muy poco frecuente), bien los presentes en la úvea anterior, el iris, como en la úvea posterior, conformada por el cuerpo ciliar y la coroides (Figura 1); de hecho, es la coroides la localización más frecuente de MU (80-90 % de los casos), seguida del cuerpo ciliar1 (12 %) y el iris (8 %). Asimismo, la mayoría de los casos proceden de nevus ya existentes, habiéndose estimado una tasa de transformación maligna de 1 de cada 8500 nevus, y se dan en pacientes sin antecedentes familiares conocidos de la enfermedad.
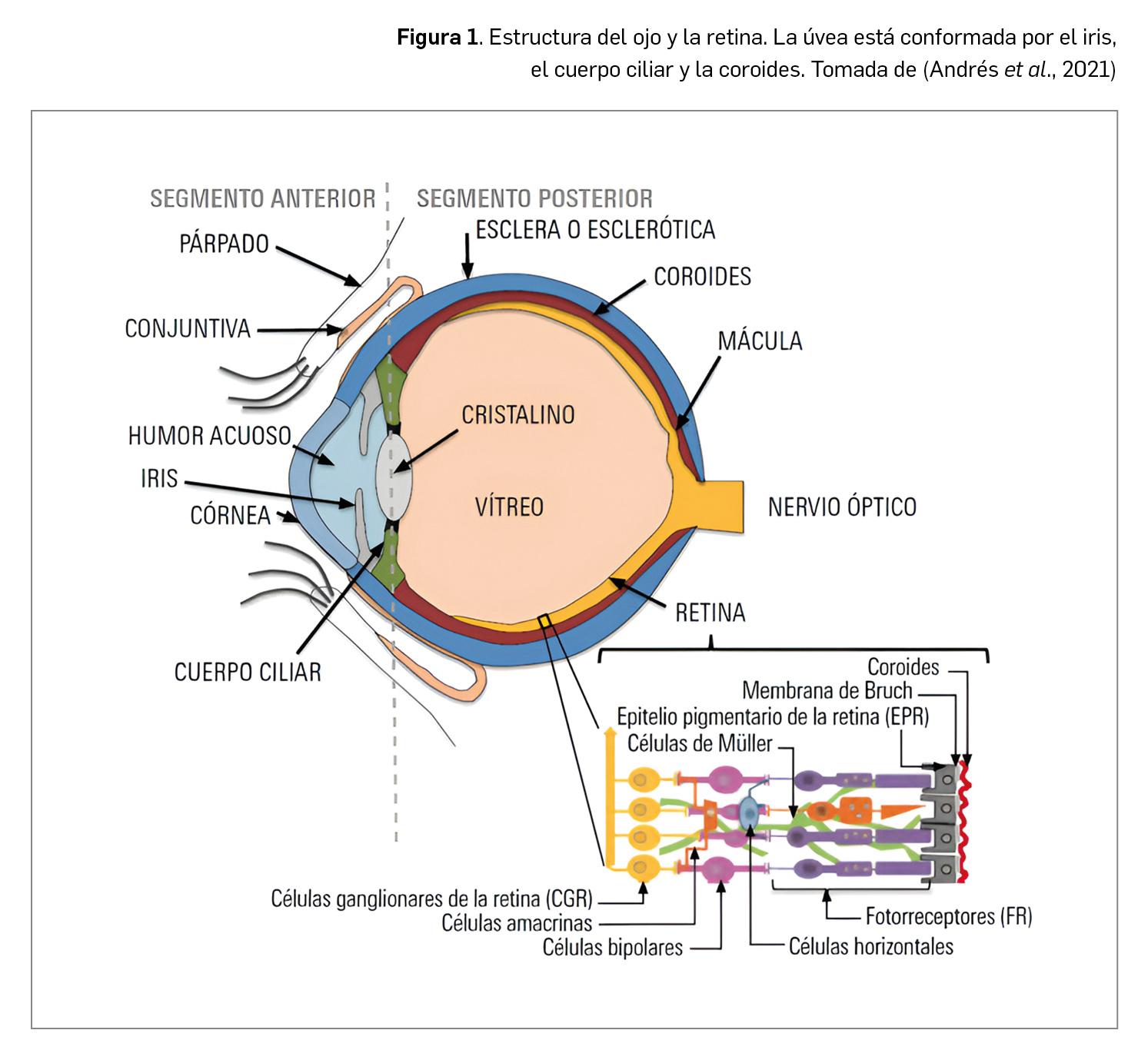
Desde el punto de vista epidemiológico, el MU es considerado, por su baja frecuencia global, como una enfermedad rara, cuya incidencia anual a nivel global oscila entre 4 y 11 casos por millón de habitantes, aunque variable según geografía (en Europa su incidencia decrece de norte a sur), raza (más frecuente en caucásicos) y edad (aumenta con la edad: suele detectarse mayoritariamente en la 6ª década de la vida, con un edad media al diagnóstico de 55 años, y un pico máximo en torno a los 70 años). Se acepta que afecta por igual a ambos sexos2 y se diagnostican cada año en todo el mundo unos 4000 nuevos casos de MU, con independencia del estadio del diagnóstico3. En España no se han divulgado datos de incidencia a nivel nacional ni por territorios concretos, pero a partir de algunos registros de tumores se ha estimado una incidencia cercana a los 4 casos por cada millón de habitantes (0,2-0,5 casos para el melanoma conjuntival), o sea, algo más de 160 casos nuevos cada año.
Esas cifras distan de la alta incidencia y prevalencia del melanoma cutáneo, un contraste que también se refleja en la efectividad y disponibilidad en número de alternativas de tratamiento. En líneas generales, el objetivo del tratamiento del MU dependerá de su estadio: si el tumor primario está localizado, se perseguirá un tratamiento definitivo que pueda permitir la curación, pero, si el paciente tiene metástasis, se buscará prolongar la supervivencia y mejorar la calidad de vida. En ambos supuestos, los factores pronósticos más importantes, además del grado de extensión4, son la edad, la localización, el tamaño, el patrón de microvasculatura y las características histopatológicas y moleculares del tumor.
Sea como fuere, se trata de una enfermedad potencialmente mortal sin tratamientos eficaces una vez que se expande y genera metástasis sistémicas, que, aunque son evidentes al diagnóstico de un MU primario en solo una baja proporción de pacientes (2-3 %), pueden después afectar a una proporción importante de ellos, más comúnmente en hígado (90 %) y menos frecuentemente, en pulmones (31 %), huesos (7-23 %) y piel (17-37 %).
Hay que subrayar que la mayoría de los pacientes están libres de enfermedad medible después de un primer tratamiento local definitivo de radioterapia y cirugía para el tumor primario, pero el desarrollo de metástasis se produce en casi la mitad de los pacientes tratados en los 5 años posteriores: la proporción de pacientes afectados por metástasis varía (5-44 %) sobre todo en función el estadio de la enfermedad al diagnóstico, creciendo con el paso del tiempo (hasta 15-73 % a los 15 años).
En el contexto metastásico, el pronóstico y los resultados en salud de los posibles tratamientos son muy pobres, sin haber existido ningún avance significativo en la supervivencia de estos pacientes (con una mediana que no supera los 12 meses y una tasa de supervivencia del 50 % al año) en las últimas 4 décadas, de modo que representa una necesidad médica no cubierta. Grosso modo, los pacientes suelen responder mal a la quimioterapia, radioterapia e inmunoterapia citotóxicas, no habiendo terapias sistémicas o locales aprobadas específicamente para el tratamiento del MU metastásico, ni tampoco ningún tratamiento que haya demostrado la reducción del riesgo de metástasis del tumor primario: ante tales circunstancias, el estándar de elección será la participación en un ensayo clínico. Cuando no existe esa posibilidad, la práctica habitual consiste en recurrir a los tratamientos disponibles frente al melanoma cutáneo avanzado; además, la resección de metástasis hepáticas prolonga la supervivencia cuando es técnicamente posible.
Para comprender la limitada magnitud del beneficio que aportan los tratamientos usados off label frente al MU metastásicos, se pueden referenciar los resultados recogidos en el informe EPAR de la Agencia Europea de Medicamentos (EMA, 2022), que alude a ensayos clínicos multicéntricos o series de casos representativas de esta condición. De forma general, la quimioterapia citotóxica como agente único se ha asociado a medianas de supervivencia global (en adelante, SG) de unos 10 meses, similar a lo observado para el uso exclusivo de los anticuerpos monoclonales inhibidores de puntos de control inmunitario (anti-PD-1 o anti-PD-L1), con medianas de SG descritas de entre 6 y 10 meses.
La combinación de un anticuerpo monoclonal anti-CTLA-4 (como ipilimumab) y un anti-PD-1 (como pembrolizumab o nivolumab) ha mostrado tasas de respuesta objetiva (en adelante, TRO) numéricamente más altas (entre 12 y 18 %), esa combinación se asocia con similares resultados en supervivencia al año (tasa ligeramente superior al 50 %) que los obtenidos con la monoterapia con anticuerpos inhibidores de puntos de control.
Acción y mecanismo
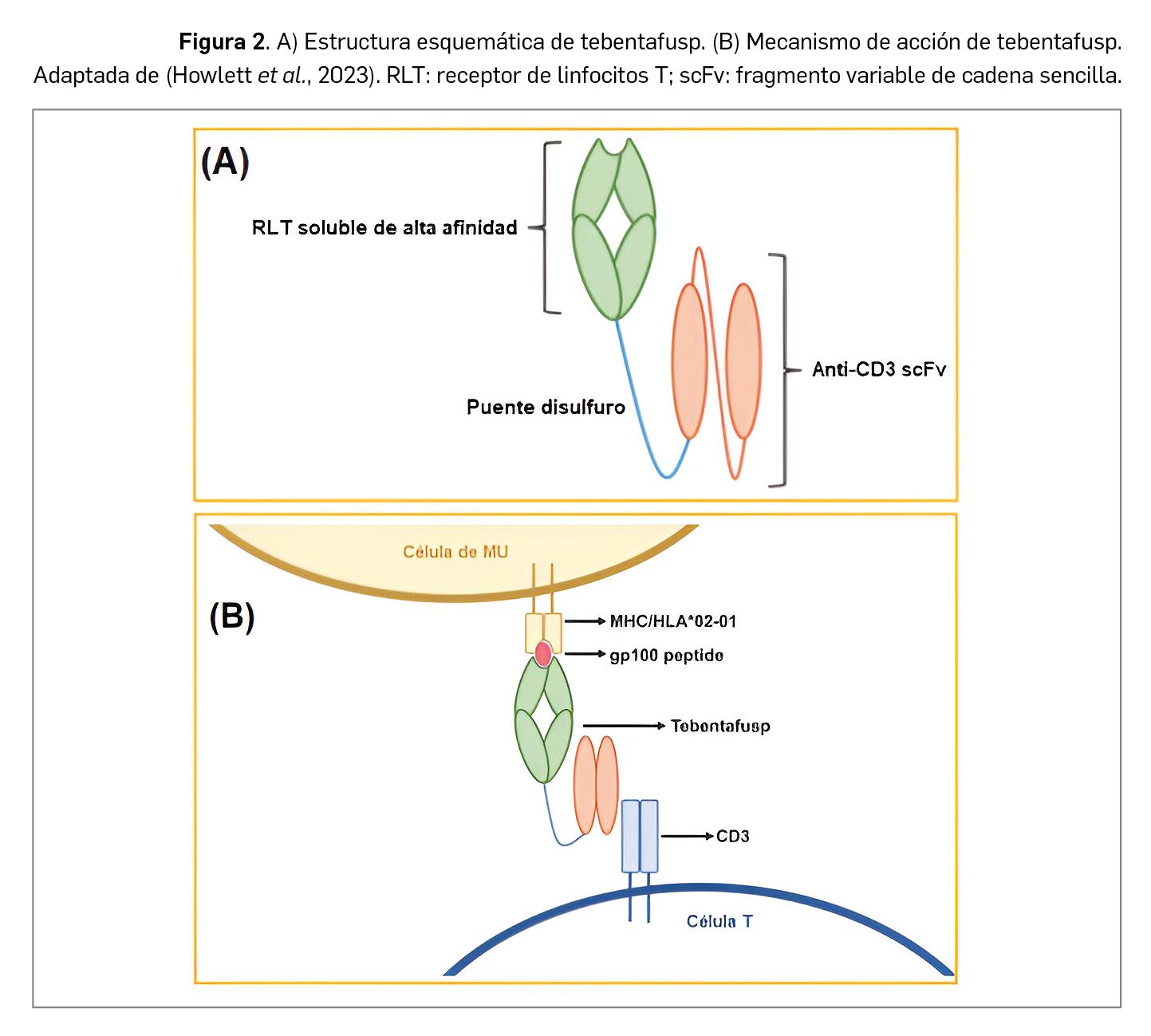
Tebentafusp es un nuevo fármaco antineoplásico consistente en una proteína de fusión biespecífica compuesta por un receptor de linfocitos T (RLT: dominio marcador) fusionado a un fragmento de anticuerpo anti-CD3 (dominio efector). El RLT se une con alta afinidad a un péptido derivado de gp100 presentado por el antígeno leucocitario humano A02:01 (HLA-A02:01) en la superficie de las células cancerosas del MU, mientras que el dominio efector se une a linfocitos T policlonales, dando lugar a una sinapsis inmunitaria que favorece la proliferación y redirige y activa a los linfocitos T policlonales productores de citocinas con actividad inflamatoria y citolítica que atacan de forma directa a las células tumorales del MU.
En base a este mecanismo, el medicamento, con designación huérfana, ha sido autorizado con indicación en el tratamiento en monoterapia del melanoma uveal irresecable o metastásico en pacientes adultos con antígeno leucocitario humano (HLA)-A02:01 positivo. En su desarrollo preclínico se probó que el dominio del RLT reconoce de manera específica el fragmento peptídico YLEPGPVTA (gp100280-288), expresado de manera exclusiva en los melanocitos y sobreexpresado en tumores melanocíticos tras ser presentado por el HLA-A02:01, por lo que la actividad de tebentafusp se restringe a pacientes con este alelo que, según se ha estimado, portaría aproximadamente el 50 % de la población europea (Seedor et al., 2023).
La selectividad de tebentafusp por gp100 se examinó en estudios in vitro, hallándose una KD de 24 pM, indicativa de una elevada afinidad, mientras que la KD para CD3 es de 38 nM, por lo que la unión a CD3 representa el factor limitante para la activación de los linfocitos T.
Aspectos moleculares
Tebentafusp es una proteína de fusión biespecífica producida mediante tecnología de ADN recombinante en células de Escherichia coli, compuesta por un receptor de linfocitos T soluble que se une con alta afinidad al péptido gp100280-288 presentado por HLA-A*02:01 (Figura 2). El fármaco está compuesto por una cadena alfa (constituida por 195 residuos de aminoácidos) y una cadena beta (de 500 residuos aminoacídicos) conectadas entre sí a través de un puente disulfuro; la cadena beta está fusionada con un dominio scFv (single-chain variable fragment o fragmento variable de cadena sencilla) con el objetivo de favorecer la activación de los linfocitos T.
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de tebentafusp han sido adecuadamente evaluadas en un estudio pivotal de fase 3, multicéntrico, abierto, aleatorizado y con control activo, en pacientes con melanoma uveal con HLA-A*02:01 positivo para el que no habían recibido tratamiento previo.
Dicho estudio incluyó a pacientes adultos con buen estado funcional (ECOG 0 o 1) y enfermedad metastásica confirmada por métodos histológicos o citológicos; la ausencia de tratamiento previo se refiere al contexto de enfermedad avanzada/metastásica, si bien se aceptaron pacientes sometidos a resección quirúrgica y terapia adyuvante o neoadyuvante previa; todos ellos debían ser candidatos a recibir alguno de los fármacos elegidos como control activo: pembrolizumab, ipilimumab y dacarbazina. Por el contrario, excluyó a pacientes con metástasis cerebral sintomática, no tratada o que requiriera del uso de corticoides en las 3 semanas antes del inicio, pacientes con enfermedad cardiovascular clínicamente relevante o con historial de reacciones de hipersensibilidad a fármacos biológicos. Los pacientes incluidos en el estudio también debían ser candidatos a recibir.
Con base en esos criterios, se aleatorizaron en proporción 2:1 a un total de 378 pacientes para recibir tebentafusp5 (n= 252) o control activo (n= 126) con el objetivo primario de determinar la eficacia comparada de tebentafusp en términos de la variable de supervivencia global (SG). Entre las principales variables secundarias de eficacia se analizaron la supervivencia libre de progresión (SLP), la tasa de respuesta objetiva (TRO) y la duración de la respuesta (DR). Las características sociodemográficas de los participantes, por lo general balanceadas entre brazos, aluden a una mediana de edad de 64 años (49,5 % tenía 65 años o más), un 50 % de mujeres y un 87 % de raza blanca. La mayoría de los pacientes del grupo control recibió pembrolizumab (82 %), siendo menos frecuente el tratamiento con ipilimumab (13 %) o dacarbazina (6 %).
Los resultados publicados (Nathan et al., 2021) son indicativos de un incremento de la SG tras un seguimiento mediano de 14,1 meses. Concretamente, la mediana de SG alcanzó los 21,7 meses en el brazo de tebentafusp frente a 16,0 meses en el brazo de control (cociente de riesgos o HR: 0,51; IC95 % 0,37-0,71; p< 0,0001). De acuerdo a datos actualizados con una mediana de seguimiento de 22,4 meses, la SG fue de 21,7 meses vs. 16,7 meses, favorable a tebentafusp (HR: 0,58; IC95 % 0,44 – 0,77; p< 0,0001), pero se debe hacer notar que la actualización se produjo tras el cruce de 16 pacientes del grupo de control a tebentafusp.
En cuanto a las principales variables secundarias, con un seguimiento mediano de 13,8 meses, la SLP alcanzó los 3,3 meses en el brazo de tebentafusp vs. 2,9 meses en el brazo control (HR: 0,73; IC95 % 0,58-0,94; p= 0,0139); la TRO fue superior con tebentafusp (10,3 % vs. 4,8 %), aunque únicamente se registró una respuesta completa con el fármaco (0,4 % vs. 0 %); y la DR mediana fue similar en ambos grupos, solo ligeramente superior con el nuevo fármaco (9,9 vs. 9,7 meses).
En pacientes previamente tratados en el contexto del MU metastásico, se dispone de un estudio de soporte de fase 1/2 abierto y no controlado (Sacco et al., 2020) en el cual se enroló a 127 pacientes en la fase 2 (expansión de dosis), con una SG de 16,8 meses tras un seguimiento mediano de 19,6 meses, que se compara positivamente con un control histórico en el que la SG fue inferior a 12 meses. La TRO alcanzó el 4,7 % (ninguna respuesta completa) y la DR fue de 8,7 meses.
De cara al análisis de la seguridad de tebentafusp, se dispone de datos de exposición de 410 pacientes con MU, 245 procedentes del estudio pivotal. El 44 % de estos pacientes interrumpió el tratamiento o necesitó al menos una reducción de dosis; un tercio (35 %) de los casos de interrupción en el estudio pivotal tuvo motivos de seguridad. Los eventos adversos los sufrieron todos los pacientes tratados con tebentafusp en los estudios clínicos, y la práctica totalidad se consideraron relacionados con el tratamiento (99,2 % en el estudio pivotal).
Los eventos más frecuentemente relacionados con tebentafusp en el estudio pivotal (≥ 30 %) fueron pirexia (76,3 %), prurito (69,0 %), erupción cutánea (55,1 %), fatiga (51,0 %), náuseas (49,0 %), escalofríos (47,8 %), hipotensión (38,8 %), piel seca (31,4 %), erupción maculo-papular (30,6 %) y cefalea (30,6 %). Entre los eventos graves, el más frecuente fue el síndrome de liberación de citocinas6 (SLC, 9,8 %), seguido de pirexia y erupción cutánea (ambos 2,4 %) e hipotensión (2,0 %). El SLC se observó en el 89 % de los pacientes en el estudio pivotal y en el 86 % de los pacientes tratados con tebentafusp; en la mayor parte de los casos, el SLC fue de grado 1 o 2 (87,7 %).
En el estudio pivotal se reportaron 84 fallecimiento: en 80 casos el motivo fue la progresión de la enfermedad, 2 ocurrieron por eventos adversos y otros 2 por otras causas. Los eventos de grado 5 no se consideraron relacionados con tebentafusp. Además, se detectó la presencia de anticuerpos anti-tebentafusp en el 29 % de los participantes en los estudios pivotal y de soporte. No se ha podido evidenciar una alteración en el perfil de eficacia o seguridad del fármaco relacionado con el título de anticuerpos.
Aspectos innovadores
Tebentafusp es un nuevo fármaco antineoplásico consistente en una proteína de fusión biespecífica compuesta por un receptor de linfocitos T (RLT: dominio marcador) fusionado a un fragmento de anticuerpo anti-CD3 (dominio efector). El RLT se une con alta afinidad a un péptido derivado de gp100 presentado por el HLA-A02:01 en la superficie de las células cancerosas del MU, mientras que el dominio efector se une a linfocitos T policlonales, dando lugar a una sinapsis inmunitaria que favorece la proliferación y redirige y activa a los linfocitos T policlonales productores de citocinas con actividad inflamatoria y citolítica, que atacan de forma directa a las células tumorales. Con base en este mecanismo, el medicamento, con designación huérfana, ha sido autorizado para el tratamiento en monoterapia del melanoma uveal irresecable o metastásico en pacientes adultos con HLA-A*02:01 positivo, administrado por vía intravenosa y a nivel hospitalario.
Su eficacia clínica fue evaluada en un estudio pivotal de fase 3 y adecuado diseño (multicéntrico, abierto, aleatorizado y con control activo), que enroló a 378 pacientes con MU metastásico HLA-A02:01 positivo para el que no habían recibido tratamiento previo. El tratamiento con tebentafusp se asoció con un incremento estadísticamente significativo de la SG –variable primaria– hasta los 21,7 meses, frente a 16,0 meses en el brazo de control (pacientes mayoritariamente tratados con pembrolizumab o ipilimumab), con una reducción del 49 % en el riesgo de muerte. Los datos de supervivencia más actualizados del estudio pivotal (Hassel et al., 2023), tras un seguimiento de al menos 3 años, están en concordancia con los analizados en el EPAR, y corroboran una reducción del 32 % del riesgo de muerte en este punto temporal (HR: 0,68; IC95 % 0,54-0,87), con una mediana de SG superior para tebentafusp frente al grupo de control (21,6 vs. 16,9 meses). No obstante, la SLP –variable secundaria– fue reducida (3,3 meses) y solo ligeramente superior al control activo, y la diferencia frente al control en la TRO (que alcanzó el 10,3 % en los pacientes tratados con tebentafusp) no fue estadísticamente significativa.
En el estudio de soporte en pacientes pretratados, la mediana de SG fue de 16,8 meses, también mejoradas si se compara con un control histórico (< 12 meses). Si bien esa evidencia de eficacia de tebentafusp en pacientes pretratados debe considerarse limitada (son datos que proceden fundamentalmente de un fase 2, abierto y no controlado, y pueden considerarse poco maduros), parece clínicamente relevante dada la ausencia de un estándar de tratamiento en este contexto.
Los citados resultados clínicos obtenidos con el nuevo fármaco se sitúan en un contexto terapéutico de reducida supervivencia con las alternativas disponibles. Por ejemplo, un meta-análisis de estudios de fase 2, con datos de más de 900 pacientes con MU metastásico, demostró una mediana de SG en el entorno de los 9 meses, con una tasa de supervivencia al año del 43 % en todas las modalidades y líneas de tratamiento (Khoja et al., 2019). Otro meta-análisis con datos de más de 2400 pacientes con MU metastásico tratados en primera línea reveló una mediana de SG de unos 12 meses, con una tasa de SG al año del 52 % (Rantala et al., 2019).
En términos de seguridad, la práctica totalidad de los pacientes tratados con tebentafusp experimentó algún evento adverso asociado al fármaco, de los cuales los más frecuentes fueron pirexia, prurito, erupción cutánea, fatiga, náuseas y escalofríos. Una elevada proporción de los casos de pirexia se relacionaron con la aparición del SLC, que fue el evento adverso grave más frecuente (10 %), aunque en la mayor parte de los casos en que apareció (88 %) fue leve o moderado en severidad, registrándose la mayor frecuencia e intensidad del SLC al inicio del tratamiento. La inmunogenicidad del fármaco, no desdeñable (aparecen anticuerpos anti-fármaco en torno al 30 % de los pacientes), no parece relacionarse con una modificación del perfil beneficio-riesgo.
Ese importante perfil toxicológico se asocia con una alta tasa de discontinuación del tratamiento por motivos de seguridad (44 %). Sin embargo, de forma paradójica, un análisis por subgrupos reveló una SG superior entre los pacientes que requirieron al menos una interrupción de la dosis frente a los que no llegaron a interrumpir el tratamiento (32,3 vs. 19,1 meses, respectivamente), si bien la mediana de SG entre quienes interrumpieron el tratamiento por eventos adversos fue de 20,2 meses.
En definitiva, tebentafusp no es el primer medicamento consistente en una proteína de fusión, pero sí es el primero dirigido a bloquear a gp100 y el primero con indicación específica en melanoma uveal avanzado/metastásico. Su administración en ese perfil de pacientes se asocia con un incremento clínicamente relevante de la supervivencia en comparación con los fármacos habitualmente empleados en este contexto terapéutico, que carecen de indicación específica, aunque ese aumento es moderado. Además, la tasa de respuesta, de tan solo el 10 %, puede considerarse escasa.
Teniendo eso en consideración, el importante perfil de toxicidad del fármaco –en el que sobresale una moderada incidencia de SLC– parece clínicamente manejable con adecuado tratamiento y vigilancia, por lo que se puede considerar que sus beneficios superan a sus riesgos.
Tebentafusp es, por tanto, el primer tratamiento que ha conseguido mejorar el pronóstico de estos pacientes en décadas, posicionándose como la principal opción para pacientes con melanoma uveal HLA-A*02:01 positivo, tanto en primera como en sucesivas líneas, aunque el beneficio en pacientes no pretratados puede ser mayor. Sin embargo, el discreto aumento de la supervivencia asociado a su administración y la baja tasa de respuesta plantean incertidumbre sobre el grado de innovación que tebentafusp aporta.

Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica Kimmtrak® (tebentafusp). Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1221630001/FT_1221630001.html.pdf.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de tebentafusp (Kimmtrak®) en melanoma uveal irresecable o metastásico en pacientes adultos con antígeno leucocitario humano (HLA)-A*02:01 positivo. IPT, 127-2023/V1/10042023. 2023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2023/IPT-127-Kimmtrak-tebentafusp.pdf.
-
- Andrés V, Vicario M, Bravo I, Herrero R. Glaucoma y degeneración macular asociada a la edad. En: Trastornos respiratorios, genitourinarios, dermatológicos, oftalmológicos y otológicos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2021. p. 355-390.
-
- European Medicines Agency (EMA). Kimmtrak®. European Public Assessment Report (EPAR). EMA/206916/2022. 2022. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/kimmtrak-epar-public-assessment-report_en.pdf.
-
- Hassel JC, Piperno-Neumann S, Rutkowski P, Baurain JF, Schlaak M, Butler MO et al. Three-Year Overall Survival with Tebentafusp in Metastatic Uveal Melanoma. N Engl J Med. 2023; 389(24): 2256-66. DOI: 10.1056/NEJMoa2304753.
-
- Howlett S, Carter TJ, Shaw HM, Nathan PD. Tebentafusp: a first-in-class treatment for metastatic uveal melanoma. Ther Adv Med Oncol. 2023; 15: 17588359231160140. DOI: 10.1177/17588359231160140.
-
- Khoja L, Atenafu EG, Suciu S, Leyvraz S, Sato T, Marshall E et al. Meta-analysis in metastatic uveal melanoma to determine progression free and overall survival benchmarks: an international rare cancers initiative (IRCI) ocular melanoma study. Ann Oncol. 2019; 30(8): 1370-80. DOI: 10.1093/annonc/mdz176.
-
- Nathan P, Hassel JC, Rutkowski P, Baurain JF, Butler MO, Schlaak M et al. Overall Survival Benefit with Tebentafusp in Metastatic Uveal Melanoma. N Engl J Med. 2021; 385(13): 1196-206. DOI: 10.1056/NEJMoa2103485.
-
- Rantala ES, Hernberg M, Kivelä TT. Overall survival after treatment for metastatic uveal melanoma: a systematic review and meta-analysis. Melanoma Res. 2019; 29(6): 561-8. DOI: 10.1097/CMR.0000000000000575.
-
- Sacco JJ, Carvajal R, Butler MO, Shoushtari AN, Hassel JC, Ikeguchi A et al. A Phase (ph) II, Multi-Center Study of the Safety and Efficacy of Tebentafusp (tebe) (IMCgp100) in Patients (pts) with Metastatic Uveal Melanoma (mUM). Ann Oncol. 2020; 31(7): S1442-S1443.
-
- Seedor RS, Orloff MM, Pancholy P, Terai M, Sato T. HLA discordance between blood and tumor: a treatment conundrum? J Clin Oncol. 2023; 41(16): e21577. DOI: 10.1200/JCO.2023.41.16_suppl.e21577.
1 Los melanomas del cuerpo ciliar son los que tienen peor pronóstico. Los melanomas del iris, por su parte, suelen ser de menor tamaño, crecimiento más lento y menor potencial de metastatizar que los de úvea posterior, con histología de rasgos más favorables.
2 En España se ha descrito una ligera tendencia a ser más frecuente en mujeres.
3 La estadificación del MU se basa en la clasificación del American Joint Committee on Cancer (AJCC 8th Edition) que define los estadios con la clasificación TNM: tumor, ganglio linfático y metástasis.
4 La tasa de supervivencia a 5 años varía del 96-97 % para los casos diagnosticados en estadio I y hasta el 25-26 % para el estadio IIIC.
5 En una pauta de administración intravenosa de 20 μg en el día 1, 30 μg en el día 8, 68 μg en el día 15 y 68 μg una vez a la semana a partir de entonces. Esta pauta coincide con la autorizada en ficha técnica.
6 El SLC es una reacción caracterizada por fiebre, taquipnea, cefalea, taquicardia, hipotensión, rash e hipoxia causada por una liberación masiva de citocinas como IL-1, IL-2, IL-6 o interferón gamma y que puede conducir a la muerte del paciente. Su potencial gravedad ha motivado que en la ficha técnica de Kimmtrak® (tebentafusp) se haya incluido la advertencia de administrar medicación previa antes de empezar la perfusión del medicamento, mantener al paciente en vigilancia durante un periodo de tiempo determinado en función de las reacciones previas y administrar de forma inmediata tocilizumab o corticosteroides en caso de que se produzca el SLC.




